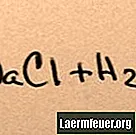
Contenu
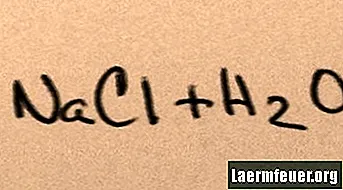
Lorsque le sel est ajouté à l'eau, il se dissout dans ses molécules constitutives jusqu'à ce que le maximum d'ions de sel que l'eau peut supporter flottent autour des molécules d'hydrogène et d'oxygène. Lorsque cela se produit, la solution est dite «saturée». Lorsque plus de sel est dissous, les ions sodium et chlorure entrent en collision et se recombinent en cristaux de sel. Ce phénomène est appelé «précipitation», car le solide formé tombe au fond de l'eau. Les sels sont "hydrophiles", c'est-à-dire qu'ils sont attirés par l'eau. Cette attraction facilite une forme familière de précipitation: des gouttes de pluie se forment autour de minuscules cristaux de sel dans les nuages, ce qui leur donne un goût légèrement salé.
Les bases

Électrolytes

Le sel ne conduit pas l'électricité à l'état solide, mais à l'état fluide (liquide), il forme une solution qui peut très bien conduire l'électricité. La conductivité dépend du type de sel utilisé, mais ces liquides, appelés solutions électrolytiques, sont d'excellents vecteurs de composés nécessaires au corps humain. Les impulsions électriques générées par le cerveau produisent de l'oxygène libre, qui est utilisé par le sang. Les molécules de sel sont classées en électrolytes (sodium, potassium ou calcium) et en chlorures en solution: le chlorure est pompé par le sang et les reins dans l'urine, et les électrolytes sont distribués à travers le système neuromusculaire dans un processus que les athlètes appellent réhydratation.
Propriétés colligatives

Toute solution diffère de sa composition d'origine car l'ajout de molécules, même lorsqu'elles ne forment pas de nouveaux composés, modifie le poids moléculaire du liquide et affecte ses propriétés. L'eau salée est plus dense que l'eau pure et gèle également plus lentement. Au fur et à mesure qu'il gèle, le sel migre vers les limites du liquide, le rendant plus lourd et plus saturé, puis abaissant son point de congélation. A l'autre extrémité de l'état de la matière, plus l'eau salée est dense, plus il faut de chaleur pour s'évaporer, jusqu'à ce que l'eau s'écoule, laissant une couche de sel. Les cuisiniers attendent que l'eau de la casserole bouillonne pour ajouter du sel, afin de ne pas retarder le chauffage. Ces qualités, appelées «propriétés colligatives», aident les scientifiques à déterminer le poids moléculaire de l'eau salée. Si la masse, la pression atmosphérique et le point d'ébullition du liquide peuvent être mesurés, les scientifiques peuvent soustraire le poids moléculaire de l'eau pour découvrir quels sels sont présents.