
Contenu
- Les instructions
- Nombre d'électrons dans la couche de valence
- Structure de Lewis
- Charge formelle de chaque atome
- Avis
- Ce dont vous avez besoin
Lors de la détermination de la charge formelle d'une molécule telle que CoCl2 (gaz phosgène), il est nécessaire de connaître le nombre d'électrons dans la couche de valence de chaque atome et la structure de Lewis de la molécule.
Les instructions

-
Recherchez chaque atome dans le tableau périodique des éléments pour déterminer le nombre d'électrons dans la couche de valence.
-
Rappelons que deux électrons sont dans le premier sous-niveau s, deux dans le deuxième sous-niveau s, six électrons dans le premier sous-niveau p, et ainsi de suite. Rappel: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Hit la charge. Si la molécule est un ion, ajoutez ou soustrayez un ou plusieurs électrons du total pour atteindre la charge finale.
-
Pour le CoCl2 (gaz phosgène): C = 4; O = 6; Cl = 7. La molécule n'est pas ionisée et a une charge neutre. Par conséquent, le nombre total d'électrons dans la couche de valence est 4 + 6 + (7x2) = 24.
Nombre d'électrons dans la couche de valence
-
Voir le diagramme de structure de Lewis de CoCl2 (gaz phosgène). La structure de Lewis représente la structure la plus stable et la plus probable pour la molécule. Les atomes sont dessinés avec des électrons de valence appariés; des liaisons sont formées entre électrons libres pour satisfaire à la règle de l'octet.
-
Dessinez chaque atome et ses électrons de valence, puis formez des liaisons si nécessaire.
Electrons dessinés sur la structure de Lewis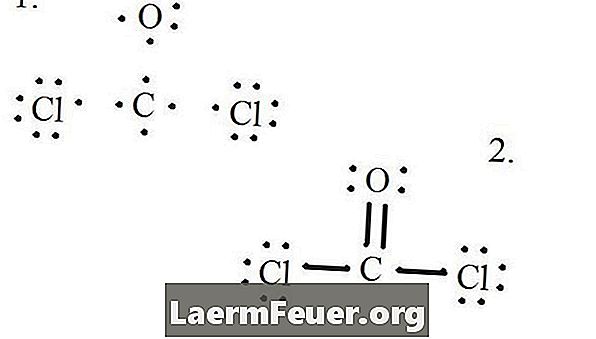
-
Les atomes de chlorure partagent des liaisons simples avec la molécule de carbone, tandis que l'atome d'oxygène forme une double liaison avec le carbone. Chaque atome de la structure finale satisfait à la règle de l'octet et possède huit électrons dans la couche de valence, permettant ainsi la stabilité moléculaire.
Structure de Lewis
-
Compter les paires d'électrons libres de chaque atome de la structure de Lewis. Chaque atome désigne un électron de chaque liaison à partir duquel il participe. Ajoutez ces chiffres. En CoCl2: C = 0 paires libres plus 4 électrons de liaison = 4 électrons. O = 4 électrons de paires libres plus 2 électrons de liaisons = 6 électrons. Cl = 6 électrons de paires libres plus un électron d'une liaison avec C = 7 électrons.
-
Soustrayez la quantité du nombre d'électrons dans la couche de valence sur l'atome non lié. Le résultat est la charge formelle pour chaque atome. Dans le CoCl2: C = 4 électrons de valence (ev) dans l’atome non lié moins 4 électrons désignés dans la structure de Lewis (LS) = 0 charge formelle O = 6 ev - 6 LS = 0 charge formelle Cl = 7 et - 7 LS = 0 accusation formelle
Charges formelles d'atomes
-
Lorsque vous écrivez, placez ces charges près des atomes dans la structure de Lewis. Si au total la molécule a une charge, placez la structure de Lewis entre parenthèses avec la charge écrite à l'extérieur dans le coin supérieur droit.
Charge formelle de chaque atome
Avis
- Le calcul de la charge formelle pour les molécules contenant des métaux de transition peut être perfide. Le nombre d'électrons dans la couche de valence pour les métaux de transition sera celui qui sort du schéma des gaz rares.
Ce dont vous avez besoin
- Tableau périodique des éléments